工业制取乙炔的方法分为水解电石法、甲烷部分氧化法、等离子体裂解法。
一、电石法分为干法与湿法。
湿法电石法就是把电石(由煤与石灰石熔融而来)加入水中产生乙炔,缺点有:耗水量极大,反应不可控;而且由于水多,导致乙炔在水中部分溶解,降低乙炔产率;残渣(Ca(OH)₂石灰浆)含水量大,需要额外增加设备进行压滤。
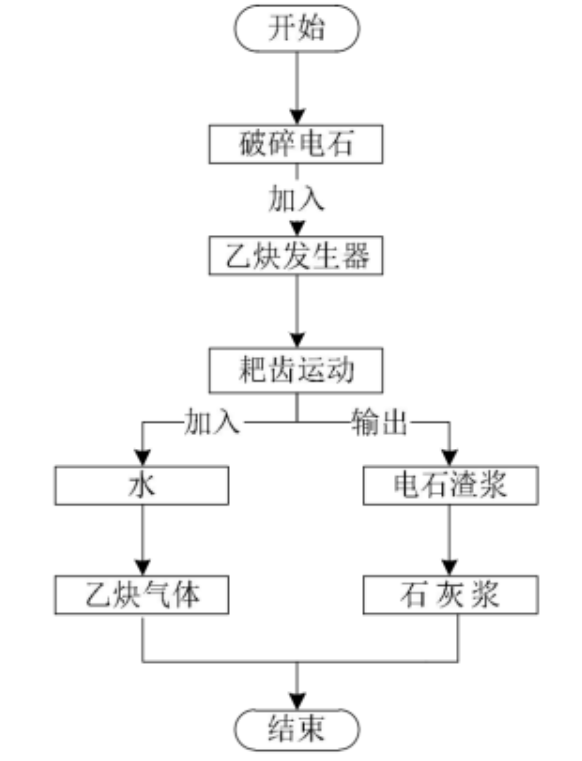
干法电石法也是电石与水的反应,但不是电石投入水中,而是反过来,把水加入电石中。先将电石粉碎后,再把水以雾状的形式喷入。由于水是后加入的,可以控制,所以产生的Ca(OH)₂含水量低,不像湿法那样是糊状的,减少了对残渣的处理成本,可直接回收Ca(OH)₂。用水量有效降低(干法相对量为1,湿法相对量约为15),而且不用担心乙炔在水中溶解,产率提高。
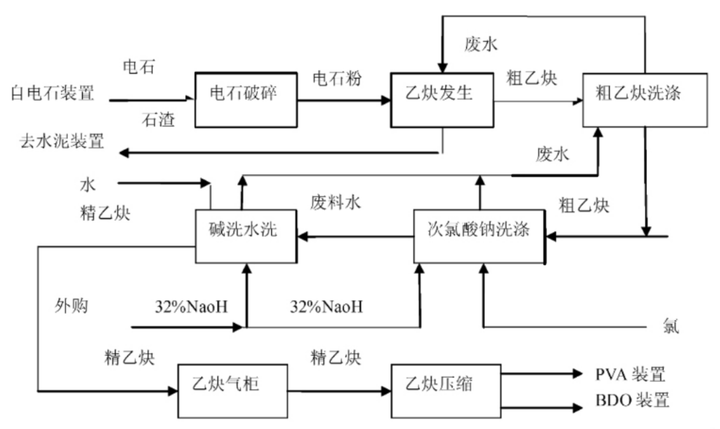
不管是干法还是湿法工艺,都有扬尘污染、噪声污染等对人体有害的危险,且乙炔是可燃气体,所以爆炸也是此类工业中常见的危险。
另外,我们在实验室制备乙炔中知道,电石产生乙炔时也会产生H₂S、PH₃等气体,工业也是如此,具体副反应如下。
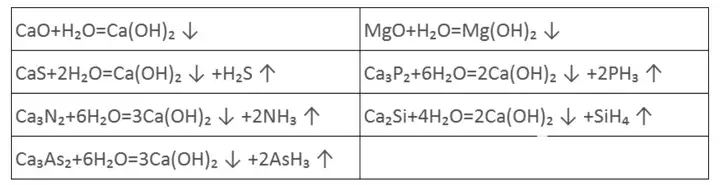
这些气体其一是会污染环境。其二,乙炔气体生产出来后有一大部分是用于合成工业原料氯乙烯,H₂S、PH₃对合成氯乙烯的催化剂有害。工业上常用浓硫酸或次氯酸钠除杂S、P污染物。
电石法制备乙炔依旧是我国制备乙炔的主流,占比约九成。
二、甲烷部分氧化法
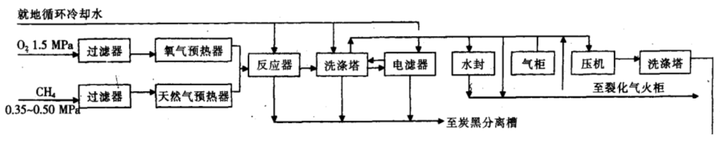
甲烷部分氧化法是利用CH₄在高温下分解重整后生成乙炔。
大致流程是:先讲甲烷与氧气按照一定比例混合,加热到一定程度先进行部分燃烧,燃烧放热,可为后续的分解提供热量,进入乙炔炉后,燃烧与分解同时进行,分解重整后,快速进入淬冷室冷却。
我们知道烷烃在长时间高温下会裂解为C与H₂,如果能控制好时间,可以有不同产物。
与想象不同,高温下,CH₄的热稳定性不如乙炔,乙炔的热稳定性又不如C与H₂。甲烷在高温分解时,大体会经历CH₄→CₙHₘ→C+H₂。控制高温持续的时间,可以使CH₄分裂重整为乙炔,在该工艺流程中,会采取淬冷的方法使反应停留在乙炔阶段,防止其继续分解。
该法相比电石法,优点有材料易得(视国家而定),污染较少等。缺点是,由于是可燃气体与氧气在高温下反应,所以有爆炸的危险;甲烷既要燃烧提供热量,又要分解为炔,所以用气量会很大;反应过程会有较多的产物,分离起来也很麻烦。
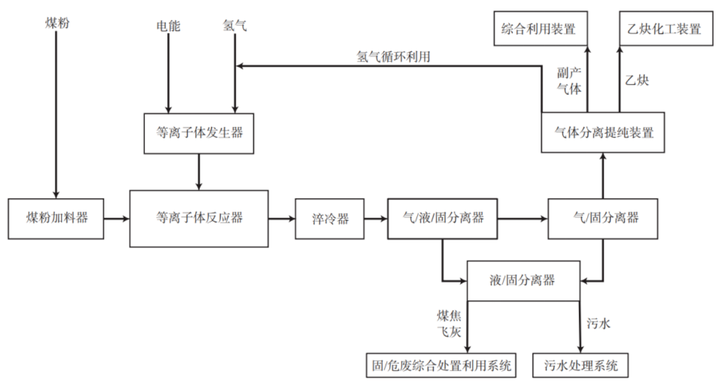
三、等离子体裂解法是较为新式的制备方法。
利用的是等离子体在高温时活性高,在极短时间内合成短链烃。等离子体原料可以来自天然气、焦炉气、煤层气等等低级烷。
相比传统的电石法,等离子体裂解法优点是清洁高效,无电石法产生的各种废渣废液废气,且产生的副产品都是利用价值高的气体,可回收利用。
难点是该反应为毫秒级反应,对设备、控制系统和工艺设计都有高要求。目前工艺不算成熟。
 上海气体网
上海气体网